
(一)杂化轨道理论的基本要要点
1.在成键过程中,由于原子间的相互影响,同一原子中参加成键的几个能量相近的原子轨道可以进行混合,重新分配能量和空间方向,组成数目相等的新原子轨道。这种轨道重新组合的过程称为轨道杂化,简称杂化。所组成的新原子轨道叫做杂化轨道。
2.杂化轨道之间互相排斥,力图在空间取得最大的键角,使体系能量降低。原子轨道杂化以后所形成的杂化轨道更有利于成键。因为杂化后原子轨道的开头发生了变化,如s轨道和p轨道杂化形成的杂化轨道,使本来平分在对称两个方向上的p轨道比较集中在一个方向上,变成一头大一头小,成键时在较大一头重叠,有利于最大重叠。因此杂化轨道的成键能力比单纯轨道的成键能力强。
(二)杂化轨道类型
根据原子轨道的种类和数目不同,可以组成不同类型的杂化轨道。这里我们只介绍s轨道和p轨道之间的杂化。
1.Sp杂化
一个s轨道和一个p轨道杂化可组成两个sp杂化轨道。每个sp杂化轨道各含有1/2s和1/2p成分。两个杂化轨道夹角为180°。
两个sp杂化轨道的对称轴在同一条直线上,只是方向相反(图4-12)。因此sp杂化轨道又叫直线形杂化轨道。
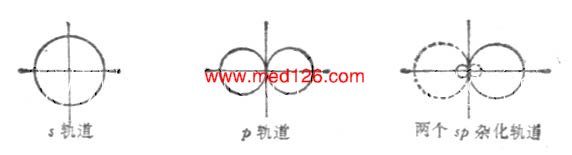
图 4-12 sp杂化轨道的形成
气态BeCL2是直线形分子,铍原子的电子层结构为1s22s2,似乎不会形成共价键。但实际上铍可与氯气反应生成BeCL2共价分子。根据杂化轨道理论,铍原子成键时,2s轨道上的一个电子先被激发到一个空的2p轨道上去,然后由含有一个未成对电子的2s轨道和2p轨道进行sp杂化形成能量相等夹角为180°的两个sp杂化轨道。两个杂化轨道再分别与两个氯原子的3p轨道重叠,形成两个互为180°的Be-Cl键,它们是(sp-p)σ键。因此BeCL2是直线形分子(图4-13)。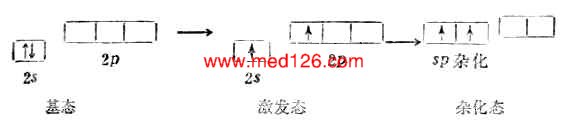
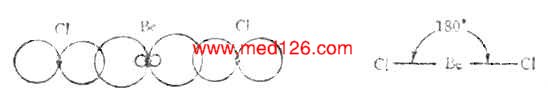
图4-13 BeCL2分子型
2.sp2杂化
一个s轨道和两个p轨道杂化可组成三个sp2杂化轨道。每个sp2杂化轨道有1/3s成分,2/3p成分。两个sp2杂化轨道间的夹角120°。
三个sp2杂化轨道的取向是指向平面三角形的三个顶角,因此sp2杂化轨道又叫平面三角形杂化轨道(图4-14)。

图4-14 三个sp2杂化轨道
BF3是平面三角形分子。硼原子的价电子结构为2s22p1。当硼与氟反应时,硼原子2s轨道上的一个电子先激发到空的2p轨道上去,然后一个2s轨道和两个2p轨道进行sp2杂化形成三个夹角为120°的sp2杂化轨道。每个sp2杂化轨道与F原子的一个2p轨道重叠组成一个(sp2-p)σ键。BG3是平面三角形结构。分子中四个原子处在同一平面上,B原子位于中心(图4-15)。
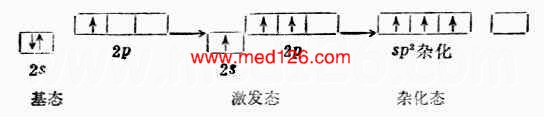
图4-15 BF分子构成
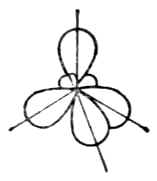
图4-16四个sp杂化轨道
3.sp3杂化
一个s轨道和三个p轨道杂化形成四个sp3杂化轨道,每个sp3杂化轨道含有1/4s和3/4p成分。每两个杂化轨道间的夹角为109°28’。
四个sp3杂化轨道的取向是指向正四面体的四个顶角。所以sp3杂化轨道也称正四面体杂化轨道(图4-16)。
在形成CH4分子时,碳原子的一个2s电子先激发到空的2p轨道上去然后一个2s轨道和三个2p轨道杂化组成四个等同的sp3杂化轨道。四个氢原子的1s轨道分别同碳原子的四个sp3杂化轨道重叠,组成四个(sp3-p)σ键,形成CH4分子。