|
(二)鲍里(Pauli)不相容原理
鲍里不相容原理的内容是:在同一原子中没有四个量子数完全相同的电子,或者说在同一原子中没有运动状态完全相同的电子。例如,氦原子的1s轨道中有两个电子,描述其中一个原子中没有运动状态的一组量子数(n,l,m,ms)为1,0,0,+1/2,另一个电子的一组量子数必然是1,0,0,-1/2,即两个电子的其他状态相同但自旋方向相反。根据鲍里不相容原理可以得出这样的结论,在每一个原子轨道中,最多只能容纳自旋方向相反的两个电子。于是,不难推算出各电子层最多容纳的电子数为2n2个。例如,n=2时,电子可以处于四个量子数不同组合的8种状态,即n=2时,最多可容纳8个电子,见下表。
|
N |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
|
L |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
|
M |
0 |
0 |
0 |
0 |
+1 |
+1 |
-1 |
-1 |
|
ms |
+1/2 |
-1/2 |
+1/2 |
-1/2 |
+1/2 |
-1/2 |
+1/2 |
-1/2 |
在等价轨道中,电子尽可能分占不同的轨道,且自旋方向相同,这就叫洪特规则。
洪特规则实际上是最低能量原理的补充。因为两个电子同占一个轨道时,电子间的排斥作用会使体系能量升高,只有分占等价轨道,才有利于降低体系的能量。例如,碳原子核外有6个电子,除了有2个电子分布在1s轨道,2个电子分布在2s轨道外,另外2个电子不是占1个2p轨道,而是以自旋相同的方向分占能量相同,但伸展方向不同的两个2p轨道。碳原子核外6个电子的排布情况如下:

作为洪特规则的特例,等价轨道全充满,半充满或全空的状态是比较稳定的。全充满、半充满和全空的结构分别表示如下:
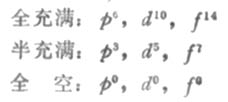
用洪特规则可以解释为什么Cr原子的外层电子排布为3d54s1而不是3d44s2,Cu原子的外层电子排布为3d104s1而不是3d94s2。
应该指出,核外电子排布的原理是从大量事实中概括出来的一般规律,绝大多数原子核外电子的实际排布与这些原理是一致的。但是随着原子序数的增大,核外电子排布变得复杂,用核外电子排布的原理不能满意地解释某些实验的事实。在学习中,我们首先应该尊重事实,不要拿原理去适应事实。也不能因为原理不完善而全盘否定原理。科学的任务是承认矛盾,不断地发展这些原理,使之更加趋于完善。
四、元素的电负性
元素的原子在分子中吸引电子的能力叫元素的电负性。元素的电负性愈大,表示该元素原子吸引电子的能力愈大,生成阴离子的倾向愈大。反之,吸引电子的能力愈小,生成阳离子的倾向愈大。表4-2列出了元素的电负性数值。元素的电负性是相对值,没有单位。通常规定氟的电负性为4.0(或锂为1.0),计算出其他元素的电负性数值。从表4-2可以看出,元素的电负性具有明显的周期性。电负性的周期性变化和元素的金属性、非金属性的周期性变化是一致的。同一周期内从左到右,元素的电负性逐渐增大,同一主族内从上至下电负性减小。在副族中,电负性变化不规则。在所有元素中,氟的电负性(4.0)最大,非金属性最强,钫的电负性(0.7)最小,金属性最强。一般金属元素的电负性小于2.0,非金属元素的电负性大于2.0,但两者之间没有严格的界限,不能把电负性2.0作为划分金属和非金属的绝对标准。
表4-2 元素的电负性
| Li |
Be |
|
|
|
|
|
|
H |
|
|
|
B |
C |
N |
O |
F |
| 1.0 |
1.5 |
|
|
|
|
|
|
2.1 |
|
|
|
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
| Na |
Mg |
|
|
|
|
|
|
|
|
|
|
Al |
Si |
P |
S |
Cl |
| 0.9 |
1.2 |
|
|
|
|
|
|
|
|
|
|
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
| K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
| 0.8 |
1.0 |
1.3 |
1.5 |
1.6 |
1.6 |
1.5 |
1.8 |
1.8 |
1.9 |
1.9 |
1.6 |
1.6 |
1.8 |
2.0 |
2.4 |
2.8 |
| Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
| 0.8 |
1.0 |
1.2 |
1.4 |
1.6 |
1.8 |
1.9 |
2.2 |
2.2 |
2.2 |
1.9 |
1.7 |
1.7 |
1.8 |
1.9 |
2.1 |
2.5 |
| Cs |
Ba |
La~Lu |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
| 0.7 |
0.9 |
1.1~1.2 |
1.3 |
1.5 |
1.7 |
1.9 |
2.2 |
2.2 |
2.2 |
2.4 |
1.9 |
1.8 |
1.8 |
1.9 |
2.0 |
2.2 |
| Fr |
Ra |
Ac |
Th |
Ha |
U |
Np~No |
|
|
|
|
|
|
|
|
|
|
| 0.7 |
0.9 |
1.1 |
1.3 |
1.4 |
1.4 |
1.4~1.3 |
|
|
|
|
|
|
|
|
|
|
素电负性的大小,不仅能说明元素的金属性和非金属性,而且对讨论化学键的类型,元素的氧化数和分子的极性等都有密切关系。 上一页 [1] [2] [3] [4]
... |

