
生理代谢
溶组织内阿米巴营兼性厌氧代谢,主要以酵解糖原获取能量。在代谢通路上因缺细胞色素及经典三羧酸循环等酶系而拥有数种特有酶系参加糖的分解反应,例如电子转运蛋白相关的还原酶系复合物可使虫体在有氧环境下有限度地利用氧,人们已利用这一酶系的还原作用研究出对阿米巴具有选择毒性作用的5-硝基咪唑类药物;溶组织内阿黧米巴可以补救途径利用各种嘌呤、嘧啶和相应的核苷合成RNA和DNA。有选择地阻断阿米巴特有的酶系作用或DNA,RNA的合成途径可用为筛选特效化疗药物的有效手段。
溶组织内阿米巴体有大量多糖贮存,在培养条件下它们能特异地利用某些糖类。实验证明米淀粉能提供滋养体最佳生长的营养条件,所以常规培养基内必须加入适量米粉,以及血清、类酯(胆固醇等)、无机盐类、多种维生素等。在肠腔或人工培养基上,阿米巴原虫与某些细菌有明显的共生现象,共生菌不仅是肠腔内阿米巴的食料,还可造成对原虫有利的相对厌氧环境,并维持适度的酸碱条件(pH)。对溶组织内阿米巴营养需求和生存条件的研究已为其体外人工培养提出不断改进,从30年代的有菌培养(xenic culture),到50年代的单栖培养(monoxenic culture),直至60年代的无共生物纯培养(axenic culture)及70年代的软琼脂克隆培养作出了贡献。
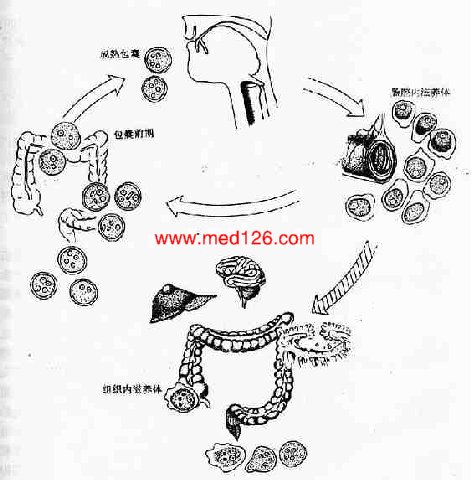
图10-2溶组织内阿米巴生活史
溶组织内阿米巴对宿主组织的侵袭力特异地表现为一种对靶物的接触性杀伤功能。这种“触杀”机制,是一个包括对靶细胞和组织的粘附、杀伤、溶噬的连锁生理过程。滋养体表膜已现有两种具植物凝血素(lectin)活性的粘附因子(adhesin)能与靶细胞糖萼中的乙酰氨基葡萄糖(GLcNAc)和乙酰氨基兰乳糖胺(GalNAc)发生受体性结合,提供了对靶细胞进行攻击的前提。已证明此种粘附活性与虫种毒力相关。阿米巴的杀伤作用是由酶溶、细胞毒、胞噬以及协同损伤等构成的综合机制。溶组织内阿米巴原虫在完成对宿主细胞的粘附、胞溶以后即随之以胞噬,而吞噬的活力则亦与虫株的的毒力和胞溶力一致。实验也证明阿米巴对宿主中性粒细胞有化学趋附性。粒细胞被滋养体触溶后释出有毒氧化物而加剧组织破坏,说明溶组织内阿米巴的侵袭并存着宿主细胞的协同作用。
致病机制
溶组织内阿米巴的致病作用是虫体和宿主的相互作用,并受多种因素影响的复杂过程。人被感染后可呈从无疾病带虫状态到急性痢疾或脓肿的各种临床类型,病理和病程复杂多变。阿米巴病的发生发展与原虫的毒力、寄生微环境的理化、生物因素以及宿主机体状态等有密切的关系。
善于种株毒力问题已如前述。根据近年来流行病学研究,同工酶分析,特异单克隆抗体测试,基因克隆的印证,致病与非致病种群的客观存在已无疑议。近十年来,全世界各地分离出6000多株溶组织内阿米巴分离株,发现了22种同工酶谱型(zymodeme),据此,可分为与临床致病完全相一致的侵袭与非侵袭型两类谱型;随后,分别制备的单克隆抗体也相应展示了两者的抗原特异性;而近年进行的基因指纹、核酸杂交以及结合多聚酶链反应的DNA扩增技术进一步显示了它们在遗传属性上是两个种群。现在,已可借助多种技术对分离株或样本中的病原进行种群鉴定。但是,阿米巴感染的发病还受虫株毒力以外的众多因素影响,其中宿主肠道内环境,特别是共生菌群的作用十分显著。志愿者实验表明吞食无菌包囊只发生带虫状态,随后吞服病人肠道菌种就发生了痢疾;国内外动物实验也证明,用混加产气荚膜杆菌等多种细菌的阿米巴感染小猫或豚鼠,其感染率均较无菌对照组为高,所致病变也较重。此种促成致病协同作用的菌群除提供有利于阿米巴增殖活动的理化条件外,还可能削弱宿主的全身或局部抵抗力,甚至直接损害肠粘膜,为阿米巴侵入组织提供条件。另外,疾病阿米巴必须突破宿主的防卫屏障才能侵入组织繁殖。