
(二)G蛋白偶联型受体及其信号转导
G蛋白偶联型受体包括多种神经递质、肽类激素和趋化因子的受体,在味觉、视觉和嗅觉中接受外源理化因素的受体亦属G蛋白偶联型受体。这类受体在结构上均为单体蛋白,氨基末端位于细胞外表面,羧基末端在胞膜内侧。完整的肽链要反复跨膜七次(图21-10),因此亦有人将此类受体称为七次跨膜受体。由于肽链反复跨膜,在膜外侧和膜内侧形成了几个环状结构,它们分别负责与配体(化学、物理信号)的结合和细胞内的信号传递。其胞浆部分可以与一种GTP结合蛋白(简称G蛋白)相互作用,这种G蛋白是该信号传递途径中的第一个信号传递分子,这也是这类受体被称为G蛋白偶联型受体的原因。
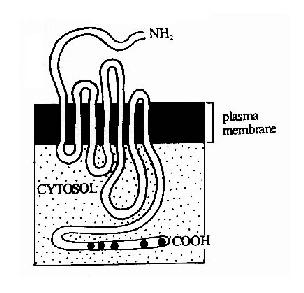
图21-10 七次跨膜受体-G蛋白偶联
型受体跨膜结构示意图
G蛋白偶联受体的信号传递过程包括(1)配体与受体结合,(2)受体活化G蛋白;(3)G蛋白激活或抑制细胞中的效应分子;(4)效应分子改变细胞内信使的含量与分布,(5)细胞内信使作用于相应的靶分子,从而改变细胞的代谢过程及基因表达等功能。本节将逐一介绍这一过程的主要环节。
1.G蛋白的循环或活化(G Protein Cycle)
G蛋白偶联型受体的信号转导途径中的第一个信号传递分子是G蛋白,其活化过程称为G蛋白循环。
G蛋白以α、βγ亚基三聚体的形式存在于细胞质膜内侧。α亚基已发现有20余种,分子量为36~52kd。α亚基具有多个活化位点,其中包括可与受体结合并受其活化调节的部位、与βγ亚基相结合的部位、GDP或GTP结合部位以及与下游效应分子相互作用的部位等等。α亚基还具有GTP酶活性。α亚基结合GDP时是无活性状态,而与GTP结合时则为有活性状态,GTP的水解又使其返回无活性状态。
G蛋白中的β和γ亚基亦有数种,但不及α亚基种类多。在细胞内,β和γ亚基形成紧密结合的二聚体,只有在蛋白变性条件下方可解离,因此可以认为它们是功能上的单体。βγ亚基的主要作用是与α亚基形成复合体并定位于质膜内侧。近年来的研究表明,βγ亚基亦可作用于其下游效应分子。

图21-11 G蛋白循环示意图
G蛋白循环的具体过程可见图21-11。当物理或化学信号刺激受体时,受体活化G蛋白使之发生构象改变。α亚基与GDP的亲和力下降,结合的GDP为GTP所取代。α亚基结合了GTP后即与βγ亚基发生解离,成为活化状态的α亚基。活化了的α亚基此时可以作用于下游的各种效应分子。这种活化状态将一直持续到GTP被α亚基自身具有的GTP酶水解为GDP。一旦发生GTP的水解,α亚基又再次与βγ亚基形成复合体,回到静止状态,重新接受新的化学信号。
由于G蛋白的种类不同,因此G蛋白可以作用于不同的效应分子,或对同一效应分子进行不同的调节。