
(2)二步法:首先用过量的戊二醛与HRP反应(HRP:戊二醛为1:105),以保证酶分子仅与戊二醛的一个醛基结合,另一个醛基游离;然后用层析法除去多余的戊二醛,制成活性HRP(HRP-戊二醛复合物),再加入过量的抗体,使活化HRP上剩余的醛基与抗体蛋白分子上的氨基结合,制成酶标抗体。过量的抗体可以保证酶与抗体间均匀连结,避免酶本身聚合。根据所用的HRP与抗体(IgG)比例不同,酶标记率各异,平均为5%~25%。标记步骤如下:
①10~15mg HRP(RZ=3.0),溶解于0.2ml 1.25%戊二醛中(0.1mol/L磷酸缓冲液配制),18h室温。
②透析或 Sephadex G-25柱层析(0.15mol/l NaCl平衡),去除过量的戊二醛,收集活化HRP。
③浓缩活化HRP至10mg/ml左右,加入抗体5mg(1.0ml 0.15mol/L NaCl 溶解)。
④碳酸盐缓冲液(pH9.5)调整pH至9.0~9.5,使抗体与活化HRP结合,4℃24h。
⑤加入0.1ml赖氨酸缓冲液,阻断未反应的醛基,4℃,2h。
⑥用半饱和硫酸铵沉淀5次,对PBS透析24h,4℃,换3次PBS,除去硫酸铵(10000rpm/min,30min)。
⑦或用凝胶色谱法(Sephadex G-200/Sephacryl S-200) 等分离标记抗体。
注意:该方法要求HRP的RZ值在3.0左右,游离氨基较少,与戊二醛反应后,制成的酶标抗体大部分为单体;而RZ值小于2.8的HRP,含有较多的游离氨基,与戊二醛反应后,易形成多聚体,使方法的敏感性下降。
2.过碘酸盐氧化法 严格地讲,过碘酸钠(Sudium periodate)不是一种真正的偶联剂,其本身并非作为桥连结在抗体和酶之间,而是借助于过碘酸钠的氧化作用,将酶连结在抗体上。该方法仅适于含糖较丰富的酶(如HRP)的标记。我们知道,HRP分子的糖本身与酶活性无关,利用过碘酸钠氧化这部分糖分子内的-CH基,使之生成-CHO基,再与抗体蛋白的游离氨基反应,生成Shiff’s碱。此Shiff’碱在pH降低时呈可逆性解离,所以经氢硼化钠(NaBH4)还原,形成稳定的酶标抗体复合物(图4-1)。为防止生成的-CHO基与酶蛋白氨基自身交联,预先可用二硝基氟苯(Dintro-fluorobenzene)处理HRP,阻断分子内的ε-、α-氨基。
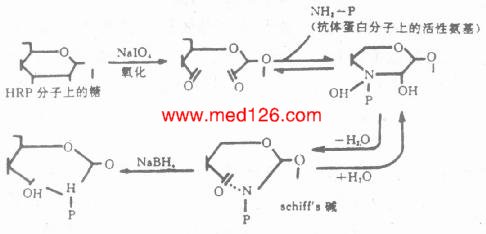
图4-1 过碘酸盐氧化原理
过碘酸盐氧化法,酶的RZ值≥3时较佳;RZ<3时,糖含量较少,游离氨基较多,氧化时酶易发生本身聚合,影响酶标抗体的产量,据报告,适当地控制过碘酸盐溶液及反应条件,几乎所加入的HRP和抗体均形成酶标抗体,其标记率为70%左右。具体步骤为:医学.全在线www.med126.com
(1)4mg HRP(RZ=3.0)溶于1.0ml双蒸水中。
(2)加0.2ml新鲜配制的0.1mol/LNaIO4,轻轻摇动混合20min,肉眼可见液体内棕黄变成深绿色。
(3)对0.1mol/L醋酸盐缓冲液(pH4.4)透析,20h,4℃。
(4)调整HRP液体的pH至9.5(一般加入20μl0.2mol/L碳酸盐缓冲液pH9.5),立即加入抗体(IgG)8.0mg/Fab 3.0mg (0.01mol/L碳酸盐缓冲液溶解),轻轻混匀后,置室温2h。PH≤8.5时,抗体的NH2基被氧化生成NH3+,后者不能与CHO基反应,所以,保持pH9.0~9.5非常重要。
(5)加入0.1ml新鲜配制的0.4%NaBH4 溶液,置1~4℃2h,以稳定酶标抗体复合物。
(6)经透析等去除未反应的NaBH4 ,避免还原过度。然后经盐析或柱层析等方法分离酶标抗体(方法同戊二醛法)。
如此制得的酶标抗体,加入终浓度1%牛血清白蛋白(Bovine Serum Albumin, BSA)分装后于-80℃可保存数年;亦可加入6%等量甘油,混匀置-20℃/4℃保存1年左右。上述两种标记法是ICC研究中最常用的酶标抗体制备方法。