
C2的序号似是补体的第2个成分,但在经典激活途径的激活顺序上却在C4以后被活化。C2分子的一级结构已全部搞清楚,它是由723个氨基酸残基组成的单肽链糖蛋白,分子量约110kDa(图5-5)。当C2与已固定于细胞膜固相上的C4b结合为复合物时,C1s丝氨酸蛋白酶可从C2肽链的精氨酸和赖氨酸(223-234)间,将C2裂解为两个片段,即C2a和C2b。C2b由N端223个氨基酸残基构成,分子量为35kDa,由细胞膜表面释放入液相中,其生物学活性至今不明。C2a由509个氨基酸残基组成,分子量为75kDa,它是构成经典激活途径中C3转化酶(C4b2a)和C5转化酶(C4b2a3b)的酶原部分。C2a的肽链上含有裂解C3和C5的蛋白酶活性点,C3转化酶与C5转化酶对C3和C5的裂解,均是由C2a的酶活性点起催化作用。
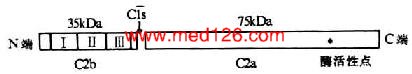
5-5 C2分子的结构(模式图)
注:Ⅰ、Ⅱ、Ⅲ为3个SCR
通过对C2的cDNA序列和氨基酸序列分析发现,C2与B因子间具有结构上的同源性。其中C2a与Bb同源,均含有裂解C3和C5的酶活性点;C2b和Ba同源,均由3个约60个氨基酸残基的短同源重复序列(short consensus repeat,SCR)构成。编码C2的基因定位于人的第6号染色体短臂21区(基因长度8kb)。