 打印本文
打印本文  关闭窗口
关闭窗口 一、氢键的本质
氢原子与电负性很大、半径很小的原子X(F,O,N)以共价键形成强极性键H-X,这个氢原子还可以吸引另一个键上具有孤对电子、电负性大、半径小的原子Y,形成具有X-H…Y形式的物质。这时氢原子与y 原子之间的定向吸引力叫做氢键(以H…Y表示)。
氢键的本质一般认为主要是静电作用。在X-H…Y中,X-H是强极性共价键,由于X的电负性很大,吸引电子能力强,使氢原子变成一个几乎没有电子云的“裸露”的质子而带部分正电荷。它的半径特别小,电场强度很大,又无内层电子,可以允许另一个带有部分负电荷的Y原子(即电负性大,半径小且有孤对电子的原子)充分接近它,从而产生强烈的静电相互作用而形成氢键。
一般分子形成氢键必须具备两个基本条件:
1.分子中必须有一个与电负性很强的元素形成强极性键的氢原子。
2.分子中必须有带孤对电子,电负性大,原子半径小的元素。
氢键常在同类分子或不同类分子之间形成,叫做分子间氢键,如氟化氢、氨水:
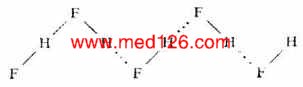

二、氢键的键长和键能
氢键的键长是指X-H…Y中X与Y原子的核间距离。在HF缔合而成的(HF)n缔合分子中,氢键的键长为255pm,而共价键(F-H间)键长为92pm。由此可得出,H…F间的距离为163pm(255-92)。可见氢原子与另一个HF分子中的F原子相距是较远的。医学全在线www.med126.com
氢键的键能是指被破坏H…Y键所需要的能量。氢键的键能约为15-30kJ·mol-1,比一般化学键的键能小得多,和范德华力的数量级相同。氢键的强弱与X和Y的电负性大小有关。电负性越大,氢键的强弱还和Y的半径大小有关,y 的半径越小,越能接近H-X键,形成的氢键也越强。例如F的电负性最大,半径又小,所以F-H…F是最强的氢键,O-H…O次之,O-H…N又次之,N-H…N更次之。
 打印本文
打印本文  关闭窗口
关闭窗口