





| 编号 | 0918 |
| 总例数 | 29例 |
| 性别例数 | 男17例,女12例 |
| 治疗组例数 | 20例 |
| 对照组例数 | 9例 |
| 年龄区间 | 18~69岁 |
| 平均年龄 | 治疗组:41.5±10.3岁;对照组:48.4±12.0岁 |
| 疾病 | 慢性丙型肝炎 |
| 并发症 | |
| 药品通用名称 | 干扰素 |
| 药品商品名称 | 佩乐能 |
| 药品英文名称 | Interferon |
| 剂型 | 注射剂 |
| 规格 | |
| 批准文号 | |
| 生产厂家 | 先灵葆雅(爱尔兰)公司 |
| 分类 | 生物制品 |
| 用药目的 | 治疗 |
| 用法用量 | 治疗组:依体重不同每周1次皮下注射佩乐能4Og或5Og(体重<65 kg者40g/次,≥65kg者50g/次),同时口服利巴韦林75O~1050mg/d(体重<65kg者750mg/d,65~84kg者900mg/d,>85kg者1050mg/d;分早、晚餐后服)。对照组:每周3次皮下注射干扰素α-2b(3mu/次),利巴韦林的剂量和服法与治疗组相同。 |
| 联合用药 | 利巴韦林 |
| 疗效评价标准 | 主要指标是持续病毒学应答率,定义为随访24周血清HCV RNA 阴性的百分比。次要指标为持续生化应答率,即随访24周血清AI T维持正常水平的百分比。所有治疗过的患者都纳入结果分析,随访期间检测结果缺失的患者按非应答处理。 |
| 治疗效果及临床指征比较 |
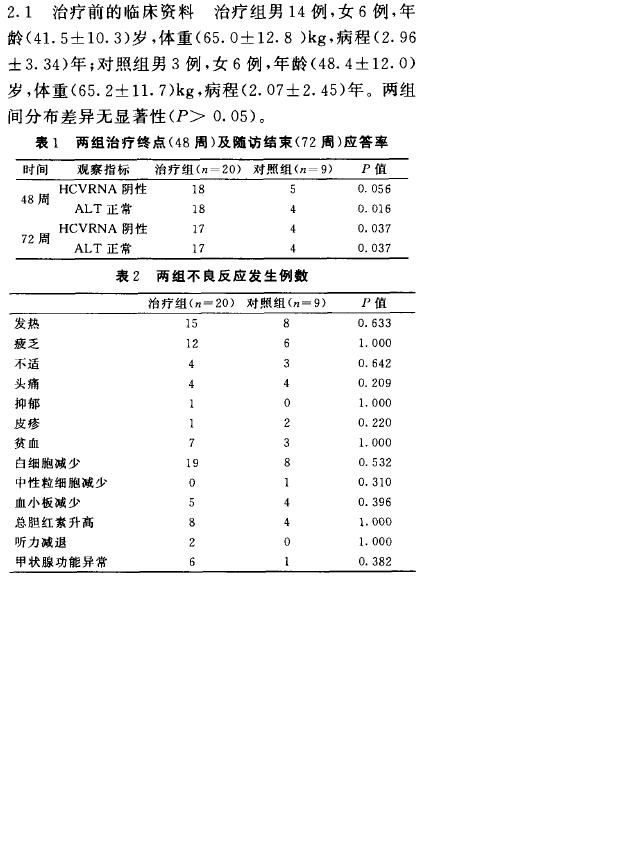 |
| 本研究报道不良反应 | |
| 其他报道不良反应 |