





| 编号 | 1354 |
| 总例数 | 90例 |
| 性别例数 | 男57例,女33例 |
| 治疗组例数 | 55例 |
| 对照组例数 | 35例 |
| 年龄区间 | 治疗组:46~73岁;对照组:44~72岁 |
| 平均年龄 | 治疗组:63.18±6.35岁;对照组:63.52±8.4岁 |
| 疾病 | 脑梗死 |
| 并发症 | |
| 药品通用名称 | 巴曲酶 |
| 药品商品名称 | |
| 药品英文名称 | Batroxobin |
| 剂型 | 注射剂 |
| 规格 | |
| 批准文号 | |
| 生产厂家 | 日本东菱株式会社 |
| 分类 | 化学药品 |
| 用药目的 | 治疗 |
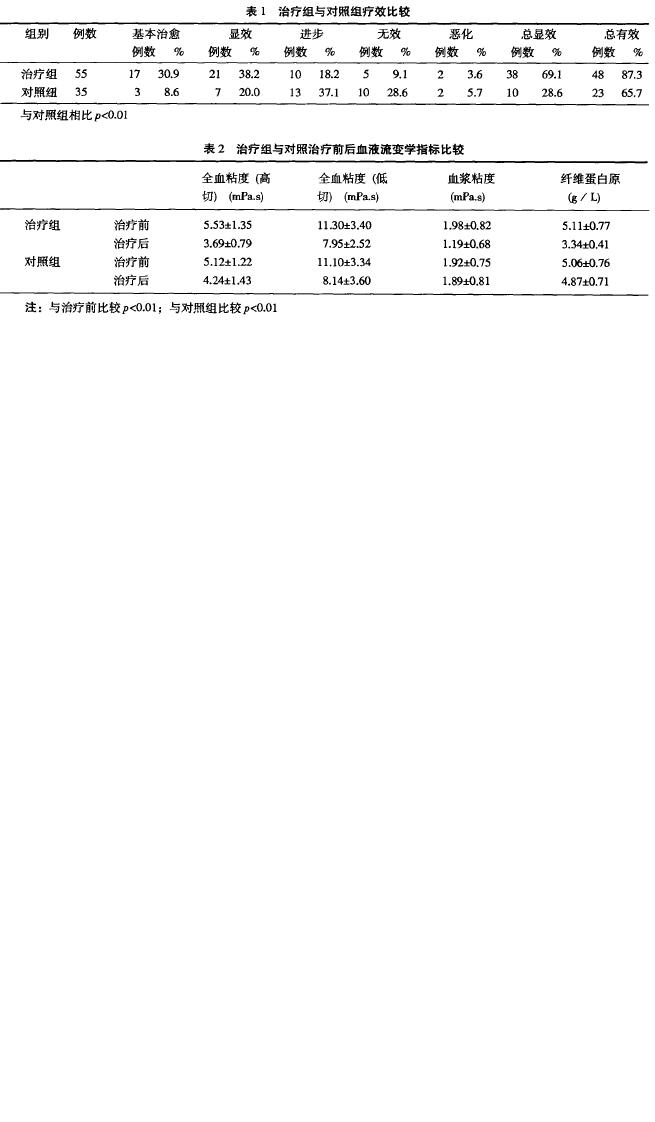
| 用法用量 | 治疗组应用巴曲酶5BU加生理盐水250ml,隔日静脉滴注,首次加倍,共3次。35例脑梗塞患者作对照研究,予以血塞通每日0.4g静脉滴注,连续lO天。 |
| 联合用药 | |
| 疗效评价标准 | 应用全国脑血管病会议制定的神经功能缺损程度及生活状态进行评分。分为:(1)基本痊愈功能缺损评分减少91%~100%,病残程度0级。(2)显著进步:功能缺损评分减少46%~90%,病残程度1~3级。(3)进步:功能缺损评分减少18%~45% ,病残程度1~3级。(4)无变化:功能缺损评分减少或增加在17%以内。(5)恶化:功能缺损评分增加18%以上。(6)死亡。 |
| 治疗效果及临床指征比较 |
 |
| 本研究报道不良反应 | |
| 其他报道不良反应 |