|
编号
|
0293
|
|
总例数
|
66例
|
|
性别例数
|
男45例,女21例
|
|
治疗组例数
|
22例
|
|
对照组例数
|
对照1组:22例;对照2组:22例
|
|
年龄区间
|
治疗组:48~80岁;对照1组:47~80岁;对照2组:47~78岁
|
|
平均年龄
|
治疗组:61.8±13.7岁;对照1组:60.5±14.3岁;对照2组:60.9±l3.9岁
|
|
疾病
|
脑梗死
|
|
并发症
|
|
|
药品通用名称
|
巴曲酶
|
|
药品商品名称
|
|
|
药品英文名称
|
Batroxobin
|
|
剂型
|
注射剂
|
|
规格
|
|
|
批准文号
|
|
|
生产厂家
|
|
|
分类
|
化学药品
|
|
用药目的
|
治疗
|
|
用法用量
|
纤维蛋白原定量<3.5 l者用DF-521 15BU,3.6g/l~4.0g/l者用20BU,4.1g/l~4.5g/l用25BU,≥4.6g/1用30BU。均以250ml盐水稀释,滴注1h以上,连用3d,第4天起改用维脑路通,0.5g/d,静脉滴注至3周结束。常规组DF-521第1天10BU,隔日5BU连用2次后继续用维脑路通,O.5g/d静脉滴注至3周末,对照组用维脑路通,0.5g/d静脉滴注,连用3周。各组病人前5治疗日均以20%甘露醇每日250ml静脉滴注。
|
|
联合用药
|
|
|
疗效评价标准
|
|
|
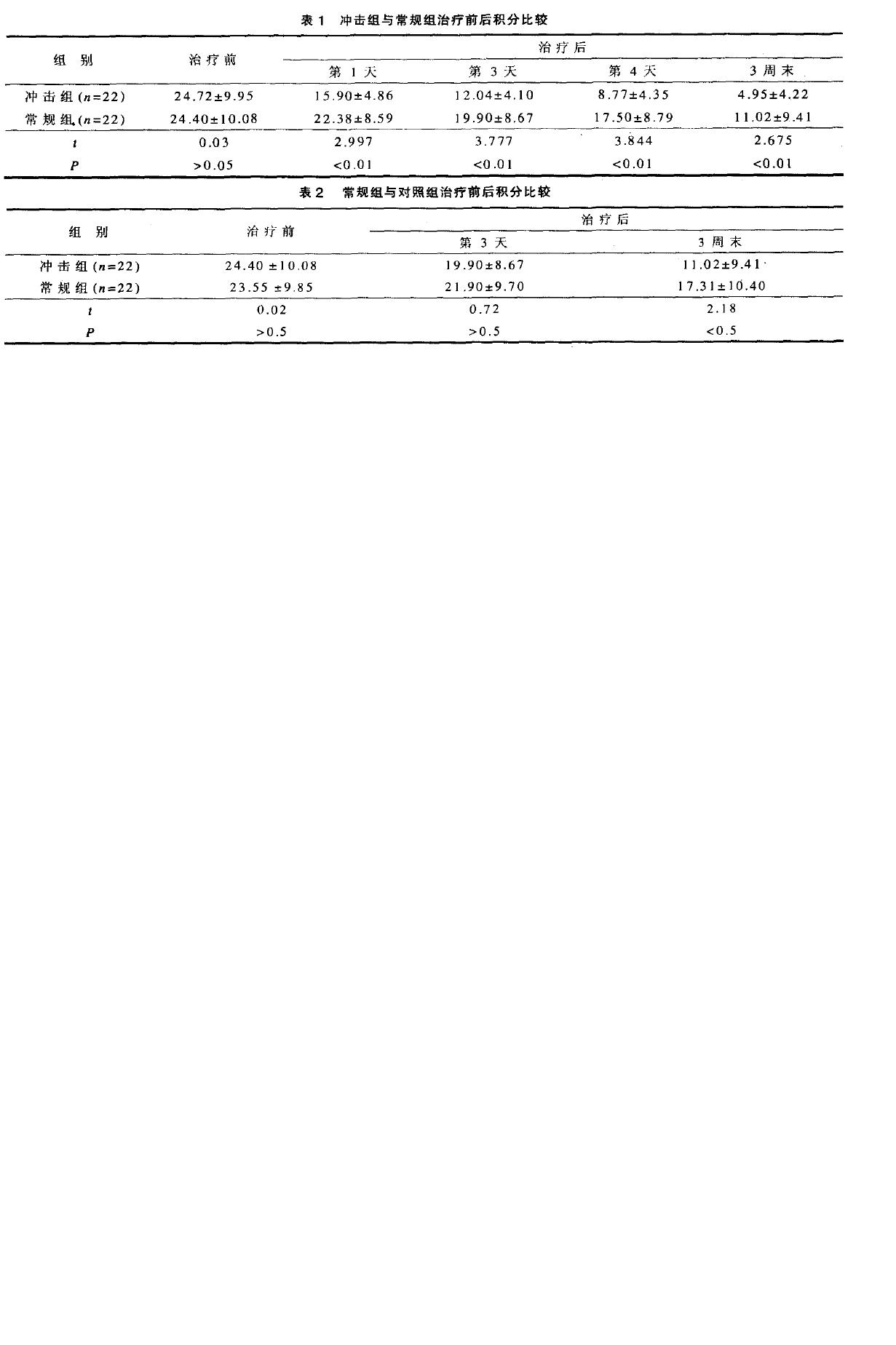
治疗效果及临床指征比较
|
结果是冲击组治愈和显效均为1O例(45%),有效2例(9%)。常规组痊愈6例(27%)、显效5例(22.7%),有效9例(41%)、无效2例(9%)。对照组痊愈2例(9%)、显效4例(18%),有效1O例(45%),无效6例(27%)。
|
|
本研究报道不良反应
|
|
|
其他报道不良反应
|
|






