|
编号
|
1047
|
|
总例数
|
25例
|
|
性别例数
|
男18例,女7例
|
|
治疗组例数
|
|
|
对照组例数
|
|
|
年龄区间
|
70~82岁
|
|
平均年龄
|
75.6岁
|
|
疾病
|
老年晚期非小细胞肺癌
|
|
并发症
|
|
|
药品通用名称
|
注射用盐酸吉西他滨
|
|
药品商品名称
|
|
|
药品英文名称
|
Gemcitabine Hydrochloride for Injection
|
|
剂型
|
粉针剂
|
|
规格
|
|
|
批准文号
|
X19990019;X19990018;H20020181;H20020180;BH20020181;BH20020180
|
|
生产厂家
|
美国礼来公司
|
|
分类
|
化学药品
|
|
用药目的
|
治疗
|
|
用法用量
|
吉西他滨1.0/m2,以0.9%生理盐水250ml溶解后30min内静脉滴注,d1,8,21d为1周期,2~4周期后进行评价。
|
|
联合用药
|
|
|
疗效评价标准
|
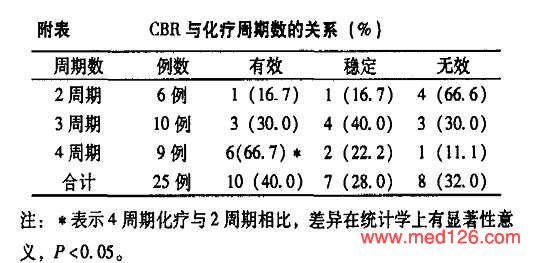
按CBR评估标准进行评价,分为有效、稳定和无效。
|
|
治疗效果及临床指征比较
|
|
|
本研究报道不良反应
|
以骨髓抑制为主,出现Ⅰ、Ⅱ度WBC下降l2例(48.%),Ⅲ、Ⅳ度WBC下降3例(12.0%),Ⅰ、Ⅱ度PL1’下降9例(36.0%),Ⅲ、Ⅳ度PLT下降4例(16.0%)。经对症治疗后,血象均可恢复正常。部分患者出现轻度肝功能异常、血色素下降和胃肠道反应,均为Ⅰ~Ⅱ度。无心、肾功能损害。
|
|
其他报道不良反应
|
|






