|
编号
|
562
|
|
总例数
|
54例
|
|
性别例数
|
男38例,女16例
|
|
治疗组例数
|
|
|
对照组例数
|
|
|
年龄区间
|
46岁~88岁
|
|
平均年龄
|
65.2岁
|
|
疾病
|
下呼吸道感染
|
|
并发症
|
|
|
药品通用名称
|
注射用头孢哌酮钠舒巴坦钠
|
|
药品商品名称
|
|
|
药品英文名称
|
Cefoperazone Sodium and Sulbactam Sodium for Injection
|
|
剂型
|
粉针剂
|
|
规格
|
|
|
批准文号
|
国药准字H20013191;国药准字H20059404;国药准字H20013190;国药准字H20059405
|
|
生产厂家
|
山东瑞阳制药有限公司
|
|
分类
|
化学药品
|
|
用药目的
|
治疗
|
|
用法用量
|
先锋必加舒巴坦,用法为每日4.0g,分2次给药。每次2.0g溶于0.9%盐水中静脉点滴,疗程7~lO天。
|
|
联合用药
|
|
|
疗效评价标准
|
根据患者咳嗽、咳痰肺部罗音、体温、呼吸困难等临床症状;白细胞计数和分类;痰细菌学检查及X 线胸部检查结果评定疗效。显效:治疗结束时,感染症状和体征消失(慢性支气管炎急性发作症状和体征至少恢复到缓解期水平),白细胞计数和分类正常,x线胸片炎性病变基本吸收。有效:感染症状和体征明显减轻,好转50% 以上,白细胞计数和分类基本正常,x线胸片炎性病变明显吸收。无效:用药3天时,体温及其它观察指标未达到有效标准,或无好转。
|
|
治疗效果及临床指征比较
|
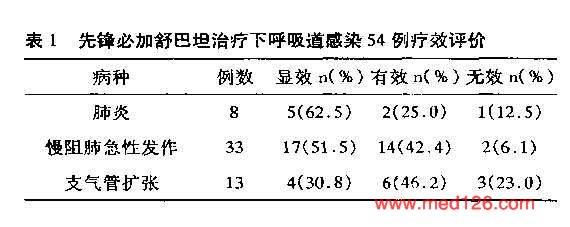
|
|
本研究报道不良反应
|
54例中10例在用药7天后出现黑便,立即停药,进行胃镜检查未见异常,考虑与用药有关,使用止血环酸静点后,5天后便潜血转阴。2例在用药前碱性磷酸酶正常,用药第8天(1例)及第10天(1例)碱性磷酸酶升高,停药后均恢复正常。1例在用药5天后出现腹泻,伴恶心、呕吐,考虑为药物反应,停药后3天症状缓解。因此本组病例不良反应发生率为7.4%。
|
|
其他报道不良反应
|
|






