





| 编号 | 34 |
| 总例数 | 40例 |
| 性别例数 | 男19例,女21例 |
| 治疗组例数 | 20例 |
| 对照组例数 | 20例 |
| 年龄区间 | |
| 平均年龄 | 治疗组(47.6±13.5)岁;对照组(49.3±15.1)岁 |
| 疾病 | 2型糖尿病 |
| 并发症 | |
| 药品通用名称 | 生物合成人胰岛素 |
| 药品商品名称 | 诺和灵R |
| 药品英文名称 | Biosynthetic Human Insulin |
| 剂型 | 注射剂 |
| 规格 | |
| 批准文号 | |
| 生产厂家 | |
| 分类 | 生物制品 |
| 用药目的 | 治疗 |
| 用法用量 | CSⅡ组统一使用胰岛素泵(Minimed 508,MiniMed公司生产,美国)和精蛋白生物合成人胰岛素(诺和灵R笔芯)作为泵用胰岛素。以起始剂量50%作为基础量,50%作为餐前大剂量方式输入。监测手指末梢血糖,每日8次(3餐前、后、睡前及凌晨3:00);MDⅡ组早、中、晚3餐前注射诺和灵R,睡前注射诺和灵N,用胰岛素笔(丹麦诺和诺德公司生产)分别于3餐前或加睡前皮下注射,同一末梢血糖仪(血糖监测采用上海罗氏公司生产的快速血糖测定仪)常规检测血糖,每日5次(3餐前、早餐后和睡前)。 |
| 联合用药 | |
| 疗效评价标准 | 预期控制目标:血糖控制达标后5~7天撤泵改用其他治疗。以早晨空腹血糖4.0~7.0mmol/L、餐后2h血糖<9.0mmol/L、睡前血糖<8.0mmol/L为预期控制目标。 |
| 治疗效果及临床指征比较 |
两组治疗前临床及生化资料比较见表1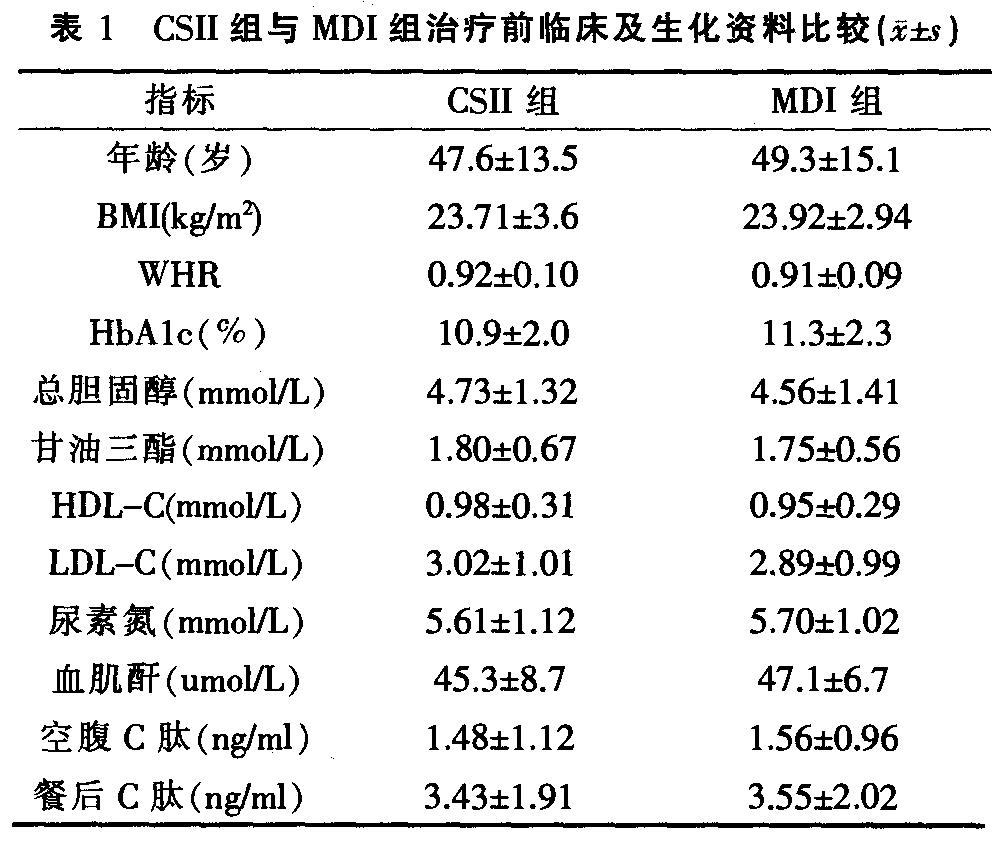 。治疗前两组间年龄、体重指数(BMI)、腰臀比(WHR)、糖化血红蛋白Alc(HbAlc)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白-C(HDL-C)、低密度脂蛋白-C(LDL-C)、尿素氮(BUN)、血肌酐(Scr)、C肽(C-P)比较差异无统计学意义(P>0.05)。两组治疗前后血糖控制情况比较见表2  。通过调整胰岛素用量,两组血糖控制均达标准,各组治疗后 |
| 本研究报道不良反应 | |
| 其他报道不良反应 |