





| 编号 | 83 |
| 总例数 | 50例 |
| 性别例数 | 男27例,女23例 |
| 治疗组例数 | 25例 |
| 对照组例数 | 25例 |
| 年龄区间 | |
| 平均年龄 | 治疗组(48.5±12.1)岁;对照组(46.7±13.6)岁 |
| 疾病 | 2型糖尿病 |
| 并发症 | |
| 药品通用名称 | 30/70混合重组人胰岛素 |
| 药品商品名称 | 甘舒霖30R |
| 药品英文名称 | 30/70 Mixture Recombinant Human Insulin |
| 剂型 | 注射剂 |
| 规格 | 100U/ml |
| 批准文号 | |
| 生产厂家 | 吉林通化东宝药业股份有限公司 |
| 分类 | 生物制品 |
| 用药目的 | 治疗 |
| 用法用量 | 全部患者住院治疗。CSⅡ组用韩国产丹纳胰岛素泵,甘舒霖(100U/ml通化东宝生物制药有限公司)持续皮下输注胰岛素,全天量的50%作为基础量输入。MDI组采用诺和灵R和诺和灵N分别于三餐前及睡前皮下注射。期间用微量血糖仪监测三餐前、后2小时及晚11时血糖。两组患者根据每天血糖情况调整胰岛素的用量,疗程2周。 |
| 联合用药 | |
| 疗效评价标准 | 血糖控制标准:FBG<7.0mmol/L,PBG<10mmol/L。当末梢血糖<2.8mmol/L无论有无症状均定义为低血糖。 |
| 治疗效果及临床指征比较 |
两组患者临床资料比较见表1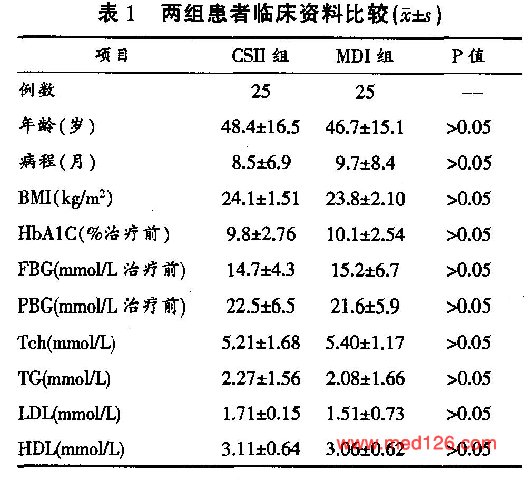 。两组患者年龄、病程、比重指数(BMI)、治疗前FBG、PBG、HbA1C、血总胆固醇(Tch)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、甘油三脂(TG)比较均无显著差异(P>0.05)。两组治疗后FBG、PBG均达标 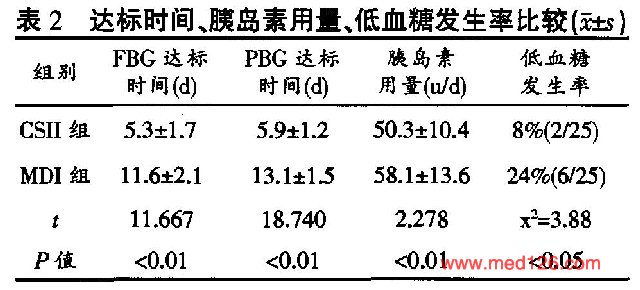 。CSⅡ组血糖达标时间、胰岛素用量、及低血糖发生率均低于MDI组(P<0.01),差异有显著性。 |
| 本研究报道不良反应 | |
| 其他报道不良反应 |