





| 编号 | 552 |
| 总例数 | 286例 |
| 性别例数 | 男性197例,女性89例 |
| 治疗组例数 | 184例 |
| 对照组例数 | 102例 |
| 年龄区间 | 25~55岁 |
| 平均年龄 | 治疗组(38±4.3),岁,对照组(36.9±3.6)岁 |
| 疾病 | 2型糖尿病 |
| 并发症 | |
| 药品通用名称 | 生物合成人胰岛素;精蛋白生物合成人胰岛素 |
| 药品商品名称 | 诺和灵R;诺和灵N |
| 药品英文名称 | Biosynthetic Human Insulin;Isophane Protamine Biosynthetic Human Insulin |
| 剂型 | 注射剂 |
| 规格 | |
| 批准文号 | |
| 生产厂家 | 诺和诺德公司 |
| 分类 | 生物制品 |
| 用药目的 | 治疗 |
| 用法用量 | 全部病例进行口服75g葡萄糖耐量试验,葡萄糖氧化酶法测定血糖,双抗放免法测定胰岛素、C肽。治疗组(ⅡT组)给予诺和灵R三餐前、诺和灵N睡前皮下注射。对照组(RT组)给予单用口服降血糖药(如格列美脲、格列吡嗪、瑞格列奈等药物)、口服降血糖药 诺和灵N每晚一次皮下注射,根据血糖调整药物剂量。两组治疗终点时复查糖耐量试验。FPG达标标准4.0~6.2mmol/L;PPG2h达标标准4.4~8.2mmol/L。 |
| 联合用药 | |
| 疗效评价标准 | |
| 治疗效果及临床指征比较 |
治疗组(ⅡT组)与对照组(RT组)两组治疗前一般情况见表1 。年龄、病程、性别、随访时间FPG,PPG2 h,FCP和PCP2 h两组无显著差异P>0.05。ⅡT组与RT组治疗后FPG,PPG2 h,FCP和CP2 h均数值的比较见表2 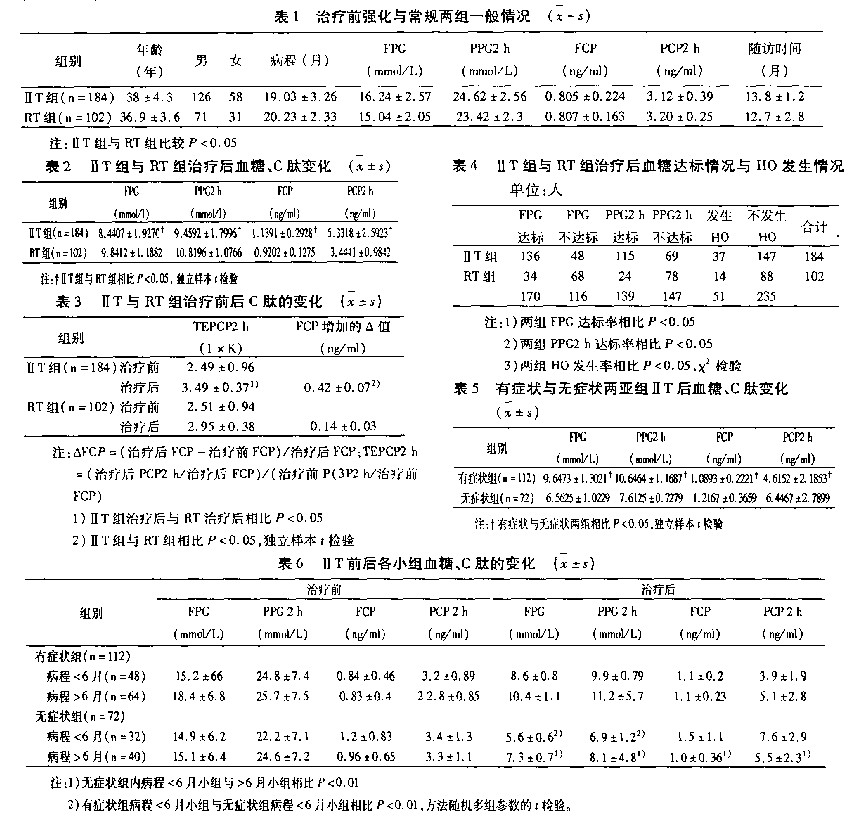 ,ⅡT组与RT组治疗后FPG,PPG2 h,FCP和PCP2 h值比较有明显差异P<0.05。ⅡT组与RT组治疗后基础C肽A值与TEPCP2 h见表3※\降血糖药\降血糖药 |
| 本研究报道不良反应 | |
| 其他报道不良反应 |


