





| 编号 | 1461 |
| 总例数 | 50例 |
| 性别例数 | 男21例,女29例 |
| 治疗组例数 | 那格列奈组25例 |
| 对照组例数 | 25例 |
| 年龄区间 | 那格列奈组:年龄22~63岁; 阿卡波糖组:年龄30~64岁, |
| 平均年龄 | 那格列奈组:平均(45±11)岁;阿卡波糖组:平均(47±10)岁 |
| 疾病 | 葡萄糖耐量异常 |
| 并发症 | |
| 药品通用名称 | 那格列奈 |
| 药品商品名称 | 唐力 |
| 药品英文名称 | Nateglinide |
| 剂型 | 片剂 |
| 规格 | |
| 批准文号 | 国药准字H20030504 |
| 生产厂家 | 那格列奈:北京诺华制药有限公司生产 |
| 分类 | 化学药品 |
| 用药目的 | 治疗 |
| 用法用量 | 两组患者饮食、运动同前,在原治疗方案不变的基础上,那格列奈组加那格列奈(商品名:唐力,北京诺华制药有限公司生产,国药准字H20030504)治疗,开始剂量60mg,三餐前15分钟口服,根据餐后血糖数值调整剂量,可以逐渐加量至120mg;阿卡波糖组加阿卡波糖(商品名:拜糖苹,中国北京拜耳医药保健有限公司,国药准字H19990205)降糖治疗,开始剂量50mg,三餐中嚼服,根据餐后血糖数值调整剂量,可以逐渐加量至1O0mg,三餐中嚼服。 |
| 联合用药 | |
| 疗效评价标准 | |
| 治疗效果及临床指征比较 |
参与者数量分析 纳人肾移植术后糖耐量异常患者50例,全部进人结果分析,无脱落。降糖作用 见表1。 血脂变化 见表2。 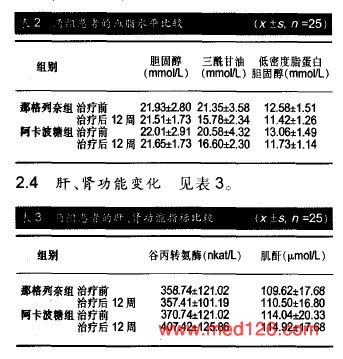 ,治疗12周后两组患者的三酰甘油水平较治疗前明显下降(P=0.000),同时那格列奈组三酰甘油水平明显低于阿卡波糖组(P=0.001)。与治疗前相比,两组治疗12周后胆固醇、低密度脂蛋白水平改善均不明显(P>0.05)。肝、肾功能变化见表3。 |
| 本研究报道不良反应 | 两组患者在整个治疗过程中未出现严重不良事件。那格列奈组患者未出现明显不良反应;阿卡波糖组患者出现不良反应7例,其中低血糖反应3例,胃肠道反应2例,皮肤瘙痒1例,同时出现低血糖及胃肠道反应1例。 |
| 其他报道不良反应 |