





| 编号 | 1435 |
| 总例数 | 239例 |
| 性别例数 | |
| 治疗组例数 | 119例 |
| 对照组例数 | 120例 |
| 年龄区间 | 年龄30~70岁 |
| 平均年龄 | |
| 疾病 | 2型糖尿病 |
| 并发症 | |
| 药品通用名称 | 那格列奈 |
| 药品商品名称 | |
| 药品英文名称 | Nateglinide |
| 剂型 | |
| 规格 | |
| 批准文号 | |
| 生产厂家 | 那格列奈:珠海联邦制药股份有限公司中山分公司生产 |
| 分类 | 化学药品 |
| 用药目的 | 治疗 |
| 用法用量 | 经国家食品及药物监督管理局批准(批准号:2002HL0152),采用多中心、分层随机、双盲、双模拟方法,经2周清洗期后进入12周治疗期。A组三餐前服120mg那格列奈(珠海联邦制药股份有限公司中山分公司生产,批号20010625)和瑞格列奈(Repaglinide)安慰剂;B组三餐前服1.0mg,瑞格列奈(连云港豪森制药有限公司生产,批号020301)和那格列奈安慰剂。疗效指标为基线期至第12周糖化血红蛋白(HbA1c)、FPG、餐后1小时、2小时血糖(PPG1、PPG2)、空腹和餐后1小时、2小时胰岛素 |
| 联合用药 | |
| 疗效评价标准 | |
| 治疗效果及临床指征比较 |
治疗12周后疗效指标分析由于人群和PP人群分析结果基本一致,以下统计均采用,人群的分析。12周后,HbA1c及FPG与基础值比较,A组和B组均有显著下降(P<0.01或0.05),A组下降幅度高于B组(P<0.05);PPG1和PPG2亦分别较基线值显著降低(P<0.01),但两组间PPG1和PPG2 的下降幅度均无明显统计学差异(P<0.05,表1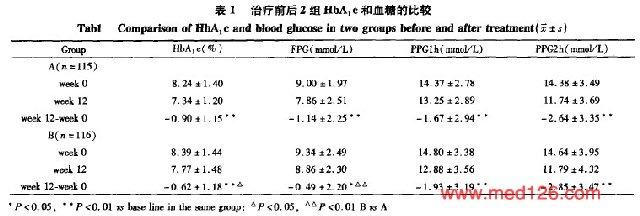 )。治疗12周后,两组INS0水平与基础值相比均无显著变化(P>0.05),INS1和INS2水平 |
| 本研究报道不良反应 | A组1例(急性感染性肠炎),B组2例(急性胰腺炎和腔隙性脑梗塞),均与研究药物可能无关。 |
| 其他报道不良反应 |