





| 编号 | 1437 |
| 总例数 | l8例 |
| 性别例数 | |
| 治疗组例数 | 9例 |
| 对照组例数 | 9例 |
| 年龄区间 | 18~4O岁 |
| 平均年龄 | |
| 疾病 | 健康受试者 |
| 并发症 | |
| 药品通用名称 | 那格列奈 |
| 药品商品名称 | |
| 药品英文名称 | Nateglinide |
| 剂型 | 胶囊; 片剂 |
| 规格 | 那格列奈胶囊:30mg;那格列奈片剂(参比制剂):30mg |
| 批准文号 | |
| 生产厂家 | 那格列奈胶囊:湖南洞庭药业股份有限公司 |
| 分类 | 化学药品 |
| 用药目的 | 测定 |
| 用法用量 | 采用双周期的随机交叉试验设计,将18名受试者随机等分成2组,每组9人,一组先服用受试制剂,后服用参比 制剂;另一组先服用参比制剂,后服用受试制剂。洗脱期为1周。给药剂量试验制剂和参比制剂均为90mg。 受试者一夜禁食后,于次日清晨服用受试制剂或参比制剂。试验制剂、参比制剂均用200ml温开水送服;服药2小时 后方能饮水;采血在临床医师的严密监护下进行,观察并记录受试者的不良反应发生情况和采取的相应措施。 |
| 联合用药 | |
| 疗效评价标准 | |
| 治疗效果及临床指征比较 |
结果1.色谱行为那格列奈和内标的保留时间分别为4.2分钟和16.4分钟。图1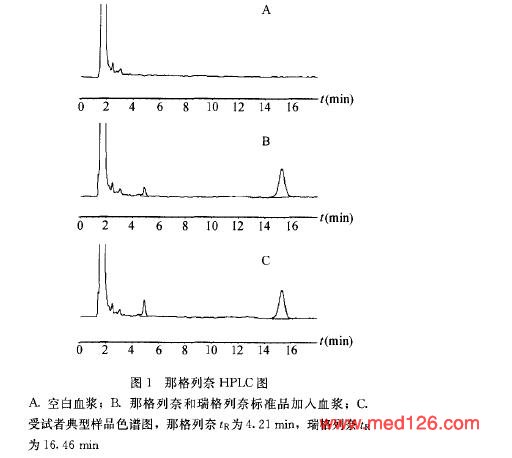 显示那格列奈在HPLC上分离效果好,空白血浆中内源性物质不干扰其测定。2.那格列奈的药物动力学18例健康志愿者口服参比制剂后各受试者的血药浓度一时间数据用DAS软件处理,其主要药物动力学参数和其他药物动力学参数见表3  ,模型分析结果表明那格列奈在人体内符合二室模型。 |
| 本研究报道不良反应 | |
| 其他报道不良反应 |