





| 编号 | 462 |
| 总例数 | 65例 |
| 性别例数 | 男32例,女33例 |
| 治疗组例数 | 0例 |
| 对照组例数 | 65例 |
| 年龄区间 | 30~65岁 |
| 平均年龄 | |
| 疾病 | 2型糖尿病 |
| 并发症 | |
| 药品通用名称 | 精蛋白生物合成人胰岛素;生物合成人胰岛素 |
| 药品商品名称 | 诺和灵R;诺和灵N |
| 药品英文名称 | Isophane Protamine Biosynthetic Human Insulin;Biosynthetic Human Insulin |
| 剂型 | 注射剂 |
| 规格 | |
| 批准文号 | |
| 生产厂家 | |
| 分类 | 生物制品 |
| 用药目的 | 治疗 |
| 用法用量 | 采用开放性研究,测定治疗前后空腹血糖(FPG)、餐后2小时血糖(2hPG)。给予三餐前诺和灵R皮下注射,晚睡前诺和灵N皮下注射,每日胰岛素总量平均65 2U。治疗2周。治疗前后分别测定FPG、2hPG、胰岛素。并计算映岛β细胞功能指数(HOMA-β)、胰岛素抵抗指数(H0MA-IR),并随访3个月,观察血糖控制情况。 |
| 联合用药 | 精蛋白生物合成人胰岛素注射液(预混30R);瑞格列奈 |
| 疗效评价标准 | |
| 治疗效果及临床指征比较 |
诺和灵R 诺和灵N治疗2周后,患者各项指标变化如表1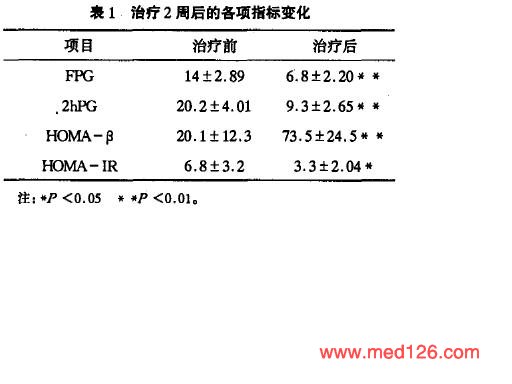 。随访3个月后,其中初诊的糖尿病有20例停药后仅采用饮食控制及配合运动。空腹及餐后血糖均控制在正常范围;另1O例改为口服诺和龙治疗,空腹及餐后血糖均在正常范围。既往有糖尿病史的患者中有17例改为口服诺和龙治疗。空腹及餐后血糖在正常范围。另18例用诺和灵30R早晚餐前皮下注射,每日胰岛亲总量为28±1.2。 |
| 本研究报道不良反应 | |
| 其他报道不良反应 |