

三、综合分析选择题
患者,男,50岁,静脉滴注上市5年内的某国产药品,7分钟后全身瘙痒,难以忍受,立即
停药,患者症状无缓解,并出现呼吸困难,血压下降至40/25mmHg,神志模糊,给予抗休克治疗,患者神志逐渐清醒,呼吸顺畅,痒感消失,血压回升至正常范围内。查询药品说明书,【不良反应】项下注明该药品可能发生过敏性休克。
91.根据《药品不良反应报告和监测管理办法》,上述信息中患者出现的临床症状为(D)
A.一般药品不良反应
B新的药品不良反应
C药品不良事件
D严重药品不良反应
92.根据《药品不良反应报告和监测管理办法》关于上述信息中的医疗机构对发生的药品不良反应处置的说法,正确的是(D)
A该药品不良反应不属于报告范围,可以不报告
B通过在医院内发布药讯代替不良反应报告
C应当立即通过药品不良反应监测信息网络报告
D应当在15日内填写药品不良反应报告表并报告
2015年5月,原国家食品药品监督管理总局发布《关于穿心莲內酯软胶囊等13种药品转换为非处方药的通知》,将穿心莲內酯软胶囊等13种药品(化学药品2种、中成药11种)转换为非处方药。具体的转换为非处方药的13种药品名单见下表:
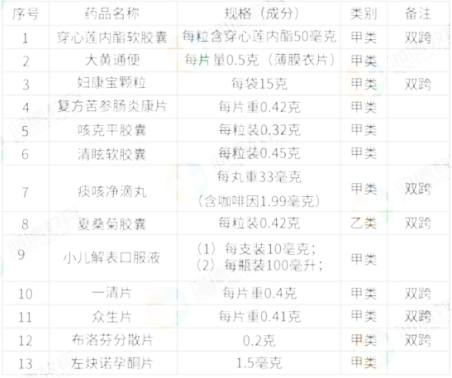
93.在上述表格中,穿心莲內酯软胶囊、妇康宝颗粒、痰咳浄滴丸等药品的类别为甲类”,备注为“双跨”,其中的“双跨”是指(A)
A.根据剂型、剂量、适应症等不同,既可作为处方药又可作为甲类非处方药
B.根据剂型、剂量、适应症等不同,既可作为甲类非处方药又可作为乙类非处方药
C.根据剂型、剂量、适应症等不同,既可作为中药又可作为中西药复方制剂
D.根据剂型、剂量、适应症等不同,既可作为口服剂型又可作为注射剂
94在上述表格中,穿心莲内酯软胶囊、妇康宝颗粒、痰咳净滴丸等药品的类别为“甲类”,备注为“双跨,”其中的“甲类”是指(C)
A从原来的甲类非处方药转为现在的“双跨”品种
B.从原来的“双跨”品种转换为现在的甲类非处方药
C.从原来的处方药转换为现在的甲类非处方药
D从原来的乙类非处方药转换为现在的甲类非处方药
95根据上述信息,关于处方药与非处方药转换评价的说法,错误的是(C)
A由国家药品监督管理部门组织有关部门和专家进行评价并批准
B处方药与非处方药转换评价属于药品上市后评论范畴
C.国家对处方药目录实行动态管理,转换评价是将处方药转换为非处方药
D.国家对非处方药目录实行动态管理,对存在安全隐患或不适宜按非处方药管理的品种要及时转换为处方药
96根据上述信息,关于转换为双跨品种后的布洛芬分散片,在其上市后可出现的具体品种管理要求的说法,正确的是(A)
A市场上可出现作为处方药和非处方药的两种布洛芬分散片
B市场上可出现包装标签上加注专有“双跨”标识的布洛芬分散片
C市场上出现的各种布洛芬分散片的说明书内容应一致
D.上市的处方药布洛芬分散片的说明书应印有本药品为双跨品种,请仔细阅读说明书并按说明书使用或在药师指导下购买和使用”的忠告语
2017年1月21日,国务院发布《第三批取消中央指定地方实施行政许可事项的决定》(国发(2017)7号),其中取消了互联网药品交易服务企业审批(第三方平台除外)行政许可事项。2017年9月29日,《国务院关于取消一批行政许可事项的决定》(国发(2017)46号)发布,决定取消互联网药品交易服务企业(第三方平台)审批的行政许可事项。2017年11月1日,国家食品药品监合管理总局发布《总局办公厅关于加强互联网药品医疗器极交易监管工作的通知》(食药监办法(2017)144号),就加强互联网药品、医疗器械交易监管工作,做好相关事中事后监督管理措施的衔接工作,作出了明确规定。
97.上述信息中提到的”第三方平台”从事的服务是指(B)
A向个人消费者提供的互联药品交易服务
B为药品生产企业、经营企业和医疗机构之间的互联网药品交易提供的服务
C通过互联网向上网用户提供的药品(含医疗器械信息服务
D药品生产企业、药品批发企业通过自身身网站与本企业成员之外的其他企业进
98.在取消品交易服务企业审批事项之后,关于上述信息中的从事联网药品交易服务资格以及药品交易合法性的说法,正确的是(C)
A.药品零售连锁企业可以直接向个人消费者提供互联网药品交易服务,在网上销售本企业经营的药品
B药品生产企业可以直接将其他企业生产的药品通过自身网站与医疗机构进行互联网药品交易
C药品监督管理部门应强化事中事后监督管理明确通过第三方平台从事活动的必须是取得药品生产、经营许可的企业和医疗机构,落实平台的主体责任
D药品批发企业可以直接通过自身网站向个人消费者提供互联网药品交易服务
药品监督管理部门在日常监督检查工作中,发现甲药品零售企业在柜台销售标示乙医院配制的治疗痤疮的外用膏剂。经立案调查,查实乙医院具有《医疗机构制剂许可证》,但在未取得制剂批准文号情况下,由医院制剂部门擅自配制,后经乙医院药剂人员丙购买并出售给甲药品零售企业甲药品零售企业所持的《药品经营许可证》的
经营范围包括化学药制剂、中成药。经抽验,该外用膏剂相应检验项目符合制剂标准规定
99.根据上述信息,乙院配制的外用膏剂应定性为(A)
A.按假药论处的药品
B合法药品
C.需要重新补办批准文号的不能定性的药品
D.只能在乙医院调剂使用的医疗机构制剂
100.对上述信息中的药剂人员丙将制剂出售给甲零售企业的行为,应定性为(C)
A.生产假药
B合法调剂药品的职务行为
C.销售假药
D非法经营
101现假定上述信息中的乙医院配制的外用膏剂已经取得批准文号,对甲药品零售企业在柜台销售行为的定性和解释,正确的是
(B)
A如果该外用膏剂通用名与某种乙类非处方药通用名一致,甲药品零售企业可以采购在柜台销售
B该外用膏剂只能凭医师处方在乙医院使用,甲药品零售企业不能销售
C经设区的市级卫生行政部门批准,该外用膏剂才能在甲药品零售企业销售
D经省级药品监督管理部门批准,该外用膏剂才能在甲药品零售企业销售
2005年5月,某县的A药品生产企业在K疫苗(第二类疫苗)生产、销售过程中,采用偷工减料弄虚作假等手段逃避监督管理,致使若干人份的效价不符合规定”的产品流向市场,有证据证明已造成接种人员健康的严重伤害后果。药品监督管理部门依据《药品管理法》有关规定,没收A企业违法生产、销售的该批K疫苗和违法所得,并依法从重处罚,罚没共计2500余万元。同时、撒销A企业K疫苗的药品批准证明文件,直接负责的主管人员和其他责任人员被移送司法机关追究相关责任。
102.上述案件中,药品监督管理部门对A企业从重处罚的理由和依据,不包括(D)
A生产、销售的产品属生物制品,属从重处罚情形
B产品已造成人员伤害后果,属从重处罚情形
C违法者弄虚作假逃避监督管理,属从重处罚情
D.产品应定性是假药,并且流入市场,属从重处罚情形
103.依法撤销A企业K疫苗药品批准证明文件的部门是(D)
A.省级药品监督管理部门
B设区的市级药品监督管理部门
C.县级药品监督管理部门
D.国家药品监督管理部门
104本案中,直接负责的主管人员和其他责任人涉嫌(C)
A.生产,销售假药罪
B危害公共卫生罪
C生产销售劣药罪
D生产,销售伪劣产品罪
105本案中,对直接负责的主管人员和直接责任人员追究行政责任为(A)
A.十年内不得从事药品生产,经营活动
B.三年内不得从事药品生产,经营活动,并处罚款
C二十年内不得从事药品生产,经营活动
D终身不得从事药品生产、经营活动
某药品生产企业生产的药品“活络止痛丸”,其功能主治为“活血舒筋,驱风除湿。用于风湿痹痛。手足麻木酸软”。在获得药品广告审查部门批准之后,广告在发布过程中出现“服用3天颈椎就不疼了;3周后10年的老风湿完全好了;服药90天变硬变形的关节恢复正常,骨病康复,行动自如”等广告内容
106对上述信息中的药品广告内容的定性,正确的是(C)
A.提供虛假材料申请药品广告审批
B任意夸大产品适应症
C含有不科学的表示功效的断言和保证
D属于不得发布广告的药品
107对上述信息中的违法药品广告行为,药品广告市查部门应采取的措施,不包括
A.撤销广告批准文号
B责令该企业停产整顿
C暂停该药品在辖区内的销售
D责令该企业在当地相应媒体上发布更正启事
108对上述信息中的违法广告,在规定的时间内,广告审查部门不再受理该企业该品种的广告审查申请。这个规定的时间指的是(B)
A.6个月
B.12个月
C.18个月
D.24个月
根据《关于将含可待因复方口服液体制剂列入第类精神药品管理的公告》(2015年第10号)和《关于加强含可待因复方口服液体制剂管理的通知》(食药监药化监(2015)46号),自2015年5月1日起,不具备第二类精神药品经营资质的企业不得再购进含可待因复方口服液体制剂。原有库存产品登记造册报所在地设区的市级药品监督管理部门备案后,按规定售完为止。自2016年1月1日起,生产和进口的含可待因复方口服液体制剂必须在其包装和说明书上印有规定的标识。之前生产和进口的,在有效期内可继续流通使用。药品标签、说明书的修改按照《药品注册管理办法》有关规定办理。
109.根据上述信息,某药品连锁经营企业库存少量的含可待因复方口服液体制剂,自2015年5月1日起,该企业的下列经营行为错误的是(C)
A.申请第二类精神药品经营资质后再继续销售
B.按含特殊药品复方制剂的管理要求,在销售时查验、登记购买者身份证号,并限定每次购买数量不能超过两盒
C.将库存产品登记造册备案后,经协商退回原供货的药品经营企业
D.将库存产品登记造册报所在地设区市级药品监督管理部门备案后,在取得第二类精神药品经营资质前,按规定销售,售完为止
110根据上述信息,关于含可待因复方口服液体制剂管理的说法,正确的是(C)
A.2015年5月1日以后上市的含可待因复方口服液体制剂在其包装和说明书上必须印有麻醉药品标识,否则不得上市
B.自公告发布之日起,含可待因复方口服液体制剂在其包装和说明书上必须印有精神药品标识,否则不得上市
C某厂2015年1月生产的某含可待因复方口服液体制剂,其有效期至2016年12月31日,该药品在2016年1月1日至有效期满前可以继续流通使用
D通知没有对含可待因复方口服片剂进行规定,所以含可待因复方囗服片剂的管理应参照通知要求执行

