 打印本文
打印本文  关闭窗口
关闭窗口 一、原电池
将锌片插入CuSO4溶液中,锌片上的Zn原子失去电子成为Zn2+而溶解;溶液中的Cu2+得到电子成为金属Cu在锌片上析出,即发生如下的氧化还原反应:

反应中电子从锌原子转移给铜离子。由于锌片和硫酸铜溶液直接接触,溶液中铜离子无秩序地自由运动,使得
Zn和Cu2+之间电子的转移是直接的、无序的,不能定向地形成电流,化学能都以热的形式散失在环境之中。
如果我们采用一个装置(图6-1),使锌原子上的电子不直接转移给铜离子,而是使还原剂Zn失去的电子沿着一条金属导线转移到氧化剂Cu2+上。这样,在导线中就有电流通过。
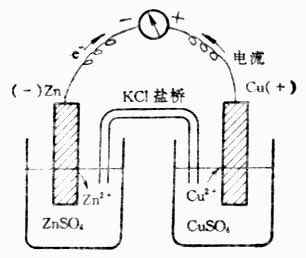
图6-1 铜锌原电池
这个装置是在盛有ZnSO4与CuSO4溶液的烧杯中分别插入锌片和铜片。两个溶液用盐桥相连。盐桥是一支U形管,通常充满用KCL(或KNO3)饱和了的琼脂胶冻。用导线联接两个金属片,并在导线中串联一个灵敏的电流计。通过实验可以看到:
电流计指针发生偏转,说明金属导线上有电流通过。根据指针偏转的方向,可以确定锌片为负极,铜片为正极。
锌片开始溶解,而铜片上有金属铜沉积上去。
取出盐桥,电流计指针回到零点,放入盐桥,电流计指针又偏转。
对上述实验现象可作如下分析:
锌片溶解说明锌片失去电子,成为Zn2+进入溶液。
Zn→Zn2++2e-
电子由锌片经金属导线流向铜片,溶液中Cu2+从铜片上得到电子成为铜原子在铜 片上析出。
Cu2++2e-→Cu
盐桥的沟通电路,使反应顺利进行。因为随着反应的不断进行,在ZnSO4溶液中,Zn2+增多,溶液带正电荷;在CuSO4溶液中,由于Cu2+变为Cu,Cu2+减少,溶液带负电荷。这样将阻碍Zn的继续氧化和Cu2+的继续还原。由于盐桥的存在,其中CL-向ZnSO4溶液扩散,K+则向CuSO4溶液扩散,分别中和过剩的电荷,使两溶液维持电中性,保证了氧化还原反应持续进行。
 打印本文
打印本文  关闭窗口
关闭窗口